Svolta anche per le terapie: bisogna intervenire il più precocemente possibile con farmaci antinfiammatori liposolubili.
Polmoniti bilaterali: scoperta la causa
Un lavoro durato quasi due anni, ma i risultati forniscono un'arma - anche di prevenzione - molto importante. Secondo quanto emerso tutto parte da particelle di grasso killer che, liberate in seguito alla distruzione delle cellule adipose, viaggiano nel sangue. Queste poi, riescono a raggiungere più organi e, una volta giunte nei polmoni, si appiattiscono sugli alveoli creando una membrana che li avvolge e che causa la mancanza di respiro. I risultati dello studio sono stati pubblicati sulla rivista scientifica “International Journal of Obesity”.
Fondamentali si sono rivelati i tessuti di 19 individui deceduti a causa del Covid-19 e di altri 23 morti per altre cause. Gli esperti, tra l’altro, hanno potuto confermare quanto già scoperto nel 2020, in un altro studio, cioè che la malattia causata dal virus Sars-CoV-2 “determina embolie grassose responsabili delle polmoniti bilaterali”.
Come spiega lo stesso Cinti:
“Le implicazioni per la terapia sono importanti perché sarebbe bene intervenire il più precocemente possibile con farmaci antinfiammatori liposolubili. Farmaci di questa tipologia riescono a sciogliersi nei grassi e permetterebbero di aggredire i lipidi liberati nel sangue dopo la distruzione delle cellule adipose. Quest'ultimo meccanismo si scatena in quanto, nelle persone obese, le cellule adipose sono costantemente sottoposte alla richiesta di immagazzinare più grassi e a poco a poco si ingrandiscono, accumulando stress, fino a disgregarsi del tutto e a morire".
Sos obesità
Secondo i ricercatori le cellule del grasso viscerale risultano essere maggiormente suscettibili a simili fenomeni di degradazione e, in pratica, il meccanismo legato alla circolazione degli emboli grassosi è più frequente nelle persone che soffrono di obesità. Il fatto che sui polmoni dei pazienti positivi al Covid si formassero delle membrane (le cosiddette “membrane ialine”) era risaputo, ma non si era capito che fossero di natura lipidica e la conferma è arrivata dalle osservazioni fatte al microscopio elettronico.
Due, dunque, le conferme giunte dallo studio. La prima è l'embolia grassosa polmonare nel 100% dei malati di Covid-19, la seconda spiega il motivo per cui le persone obese con la malattia, soprattutto quelle con obesità viscerale, possano incorrere in una prognosi peggiore.
Un tesoretto di dati importanti che consentono non soltanto di prevenire, ma anche di curare in maniera mirata i pazienti a rischio. Fonte: qui
L'infiammazione del grasso viscerale e l'embolia grassa sono associate alle membrane ialine lipidiche del polmone in soggetti con COVID-19
International Journal of Obesity ( 2022 )
Astratto
Sfondo
Dati preliminari hanno suggerito che l'embolia grassa potrebbe spiegare l'importanza dell'obesità viscerale come determinante critico della malattia da coronavirus-2019 (COVID-19).
Metodi
Abbiamo eseguito un'analisi istomorfologica completa del tessuto adiposo viscerale autoptico (IVA), polmoni e fegati di 19 soggetti con COVID-19 (COVID-19+) e 23 persone senza COVID-19 (controlli). Sono stati studiati anche gli adipociti umani (hMADS) infettati da SARS-CoV-2.
Risultati
Sebbene non vi fossero differenze tra i gruppi nell'indice di massa corporea e nella dimensione degli adipociti, è stata rilevata una maggiore prevalenza di macrofagi CD68+ tra i COVID-19+ VAT ( p = 0,005) e accompagnata dalla presenza di strutture a forma di corona, segni di stress degli adipociti e la morte. Coerentemente, gli adipociti umani sono stati infettati con successo da SARS-CoV-2 in vitro e hanno mostrato una vitalità cellulare inferiore. Essendo l'infiammazione dell'IVA associata alla fuoriuscita di lipidi dagli adipociti morti, abbiamo studiato la distribuzione dei lipidi da ORO. I lipidi sono stati osservati all'interno degli spazi interstiziali dei polmoni e del fegato, dei macrofagi, delle cellule endoteliali e del lume dei vasi, caratteristiche suggestive della sindrome da embolia grassa, più prevalente tra COVID-19+ ( p <0,001). In particolare, i segni di embolia grassa erano più prevalenti tra le persone con obesità (p = 0,03) indipendentemente dalla diagnosi di COVID-19, suggerendo che tale condizione potrebbe essere una complicazione dell'obesità esacerbata dall'infezione da SARS-CoV-2. È importante sottolineare che i polmoni di tutti i soggetti infetti presentavano membrane ialine ricche di lipidi (ORO+), formazioni associate a polmonite correlata a COVID-19, presenti solo in un paziente di controllo con polmonite non correlata a COVID-19. È importante sottolineare che sono stati osservati anche aspetti di transizione tra grasso embolico e membrane ialine.
Conclusioni
Questo studio conferma l'embolia del grasso polmonare nei pazienti COVID-19+ e descrive per la prima volta nuove caratteristiche correlate al COVID-19 che potrebbero essere alla base della prognosi sfavorevole nelle persone con COVID-19 e obesità.
Introduzione
Da dicembre 2019, la sindrome respiratoria acuta grave coronavirus 2 (SARS-CoV-2), responsabile dello sviluppo della malattia da coronavirus 2019 (COVID-19), si è diffusa a livello globale, provocando una crisi sanitaria mondiale che ha causato oltre cinque milioni di morti [ 1 ]. Il polmone è un organo bersaglio cruciale non solo a causa della grave polmonite bilaterale osservata nel 15-30% dei pazienti ospedalizzati [ 2 , 3 ] ma anche perché è il sito da cui l'infezione si diffonde ai vasi sanguigni, al cuore, all'intestino, al cervello e reni [ 4 ]. I dati pubblicati supportano la fibrosi interstiziale con formazione di membrana ialina alveolare (HM) come principale evento istopatologico sottostante responsabile di polmonite e sofferenza della sindrome respiratoria acuta [ 5, 6 ]. Le ragioni dell'espressione bilaterale di HM, dell'istogenesi e dell'improvvisa comparsa clinica durante le fasi iniziali di COVID-19 non sono completamente comprese [ 7 ].
La gravità del COVID-19 è strettamente associata alla presenza di comorbidità [ 8 ]; mentre l'obesità da sola è responsabile del 20% dei ricoveri per COVID-19, l'obesità in combinazione con diabete di tipo 2 e ipertensione rappresenta il 58% [ 9 ]. L'obesità e la ridotta salute metabolica sono infatti fortemente associate alla prognosi sfavorevole del COVID-19 e pongono anche i giovani pazienti a rischi maggiori [ 10 , 11 ]. Significativamente, l'obesità viscerale aumenta il rischio di complicanze correlate al COVID-19, indipendentemente dall'età, dal sesso, dall'indice di massa corporea [ 12 ], dalle aree di tessuto adiposo totale e sottocutaneo [ 13 , 14 , 15 , 16]. L'obesità viscerale è, infatti, fortemente associata a infiammazione cronica di basso grado, ipercoagulabilità del sangue, ridotta salute metabolica e maggiore rischio di eventi cardiovascolari, tutti fattori di rischio per la gravità del COVID-19 [ 8 , 11 , 16 , 17 , 18 ]. L'eccessiva espansione del tessuto adiposo viscerale (IVA) è parallela all'ipertrofia degli adipociti, alla morte e alla fuoriuscita di lipidi, fenomeni che provocano l'infiltrazione dei macrofagi, lo sviluppo di strutture simili a corone (CLS) e l'infiammazione, che a loro volta contribuiscono alle complicanze legate all'obesità [ 19 , 20 , – 21 ]. L'elevata espressione di adipociti ACE2 nell'obesità [ 22], recettore sfruttato da SARS-CoV-2 per l'ingresso nelle cellule, è stato spesso ipotizzato come un possibile meccanismo fisiopatologico responsabile della gravità del COVID-19 correlata all'obesità [ 8 , 23 , 24 ]. Tuttavia, sebbene l'obesità sia stata fortemente associata alla gravità del COVID-19, mancano articoli originali che analizzano in modo completo campioni di tessuto adiposo appartenenti a soggetti con COVID-19 e forniscono prove dirette dell'infezione da SARS-CoV-2 [ 16 ]. Nel nostro studio preliminare, abbiamo descritto la presenza di grasso embolico nel polmone di pazienti obesi deceduti da COVID-19 e abbiamo ipotizzato che tale segno istopatologico potesse essere dovuto allo stress degli adipociti indotto dall'infezione da SARS-CoV-2 [ 23]. Nel presente studio, abbiamo eseguito per la prima volta una valutazione istomorfologica completa di campioni autoptici di VAT, polmone e fegato appartenenti a soggetti con (COVID-19+) e senza (controlli) COVID-19 e, in particolare, ci siamo concentrati sui tessuti distribuzione lipidica. Abbiamo osservato nuove caratteristiche istopatologiche correlate a SARS-CoV-2, ovvero infiammazione dell'IVA, segni di embolia grassa in diversi organi e HM di natura lipidica nel polmone, che potrebbero contribuire alla gravità del COVID-19 tra i soggetti con obesità viscerale.
Risultati
I campioni autoptici di VAT, polmoni e fegato appartenenti a 49 soggetti sono stati raccolti e sottoposti a screening per essere inclusi nello studio. Quarantadue soggetti sono stati ritenuti idonei allo studio (ossia in buona conservazione per le analisi istomorfologiche), 19 dei quali sono deceduti per polmonite bilaterale correlata a COVID-19 (gruppo COVID-19+), mentre i restanti 23 sono deceduti per ragioni (gruppo di controllo). Le caratteristiche del soggetto, inclusi sesso, età, BMI, comorbidità e causa di morte, sono riportate nelle Tabelle Supplementari 1 e 2 . L'infezione da SARS-CoV-2 è stata valutata mediante RT-qPCR eseguita su campioni di tampone nasale faringeo o faringeo. L'età media della popolazione in studio era di 65,0 ± 14,3 anni, il BMI era 29,0 ± 5,4 kg/m2 con il 35,7% dei pazienti affetti da obesità (BMI ≥ 30,0 kg/m22 ), e il 45,2% in sovrappeso (BMI ≥ 25,0 kg/m 2 ). In totale, il 35% della popolazione era composto da donne ( n = 15). Non ci sono state differenze significative nell'età media (COVID-19+: 69,5 ± 11,0 vs controlli: 61,0 ± 16,0 anni; p = 0,09) e BMI (COVID-19+: 30,0 ± 5,0 vs controlli: 28,1 ± 5,6 kg/m2 2 ; p = 0,62) tra i nostri gruppi di studio.
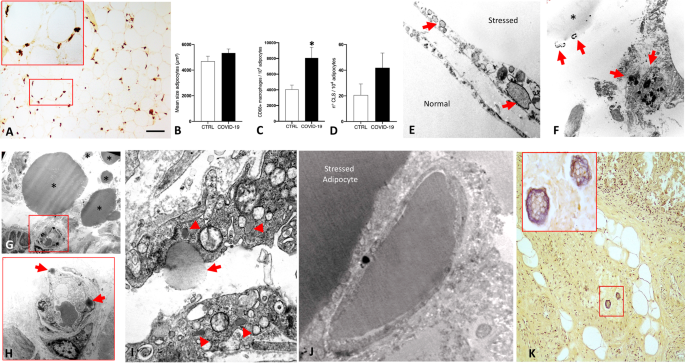
Segni inequivocabili di infiammazione cronica di basso grado sia nei soggetti COVID-19+ che nei soggetti di controllo con un BMI ≥ 25,0 kg/m 2 sono stati osservati nei campioni IVA (Fig. 1A ). Tuttavia, sebbene non vi fossero differenze tra i gruppi nella dimensione degli adipociti BMI e IVA (Fig. 1B ), in COVID sono state evidenziate una maggiore prevalenza di CD68 + macrofagi (Fig. 1C ) e una tendenza per una maggiore presenza di CLS (Fig. 1D ). -19+ rispetto ai controlli, suggerendo una maggiore infiammazione dell'IVA indotta da SARS-CoV-2. Altre cellule infiammatorie erano rappresentate principalmente da linfociti, ma il loro numero era trascurabile in tutti i casi studiati.
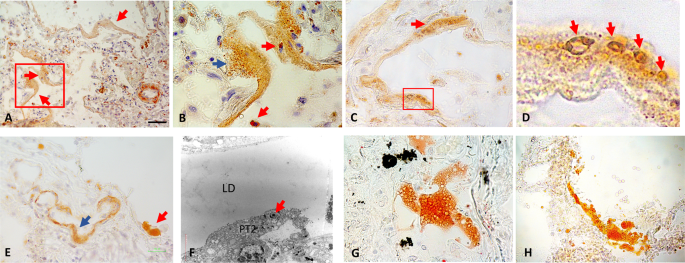
A Microscopia ottica (LM): immunoistochimica rappresentativa del tessuto adiposo viscerale infiltrato da macrofagi CD68+ (in marrone); l'inserto mostra un ingrandimento dell'area quadrata. B Area degli adipociti del tessuto adiposo viscerale, numero C di macrofagi CD68+ per 10 4 adipociti e numero D di strutture a forma di corona (CLS) per 10 4 adipociti in soggetti COVID-19+ rispetto a soggetti di controllo. L'asterisco (*) indica p < 0,05. E Microscopia elettronica a trasmissione (TEM): adipocita normale adiacente a un adipocita stressato che mostra un reticolo endoplasmatico dilatato (frecce). FTEM: adipociti morti e goccioline lipidiche interstiziali libere (*); le frecce indicano i resti di adipociti. G TEM : nei soggetti con COVID-19 (asterischi) sono state trovate frequentemente goccioline lipidiche libere di dimensione variabile. H Ingrandimento dell'area quadrata in G che mostra goccioline lipidiche all'interno delle cellule endoteliali (frecce). I TEM: ingrandimento di un capillare da un soggetto COVID-19+ che mostra una gocciolina lipidica che si estrude nel lume capillare (freccia), notare gli abbondanti corpi di Weibel-Palade che denotano una maggiore ipercoagulabilità del sangue (punte di freccia). J TEM: un capillare riempito di grasso embolico vicino ad un adipocita stressato. KLM: campione di grasso mesenterico che mostra materiale embolico ricco di lipidi in una vena (area quadrata, inserto ingrandito). I dati morfometrici sono espressi come medie ± SE. Barra della scala: A = 100 μm, E = 0,8 μm, F = 2,5 μm, G = 10 μm, H = 3 μm, I = 1,5 μm, J = 0,8 μm, K = 35 μm.
Abbiamo quindi valutato se la maggiore infiammazione dell'IVA in COVID-19+ fosse associata alla morte degli adipociti. L'immunoistochimica della perilipina 1 (PLIN1) è un metodo affidabile per identificare e quantificare gli adipociti morti [ 19 , 25 ]. Tuttavia, nel presente studio, tutti i campioni mostrano adipociti PLIN1 negativi, probabilmente a causa della natura autoptica dei campioni. Abbiamo quindi eseguito uno studio morfologico e ultrastrutturale per valutare lo stress e la morte degli adipociti VAT. La microscopia elettronica ha mostrato frequenti segni di morte degli adipociti in prossimità di CLS sia in soggetti COVID-19+ che di controllo con un BMI ≥ 25 kg/m 2 , un risultato coerente con studi precedenti che documentano la morte degli adipociti correlata all'obesità [ 26]. Inoltre, l'IVA di COVID-19+ era ricca di adipociti stressati e morti (75% in ~ 120 adipociti maturi; Fig. 1E, F ) anche in aree prive di CLS e apparentemente normali al microscopio ottico (LM). In linea con la morte diffusa osservata, i resti cellulari erano evidenti in prossimità degli adipociti morenti, mentre le goccioline lipidiche libere erano spesso trovate negli spazi interstiziali adiposi (Fig. 1 F, G ). In particolare, sono stati frequentemente osservati grandi vacuoli lipidici: (1) all'interno di cellule endoteliali appartenenti a capillari adiacenti a goccioline lipidiche libere (Fig. 1H , I ); (2) estrusione da cellule endoteliali nel lume capillare (Fig. 1I ); (3) nel lume dei capillari IVA (Fig. 1J); (4) nei macrofagi vicino a goccioline lipidiche interstiziali libere (dati non mostrati). Inoltre, diversi gruppi di strutture ricche di lipidi sono stati trovati nel lume di circa l'11% delle venule osservate nei campioni di grasso mesenterico (venule totali esaminate 175; Fig. 1K ). In sintesi, le analisi ultrastrutturali approfondite dei campioni autoptici COVID-19+ VAT hanno rivelato la presenza diffusa di goccioline lipidiche libere all'interno del lume capillare, probabilmente derivate dagli adipociti morti; tutte queste caratteristiche sottolineano una condizione in grado di generare la sindrome da embolia grassa [ 27 ].
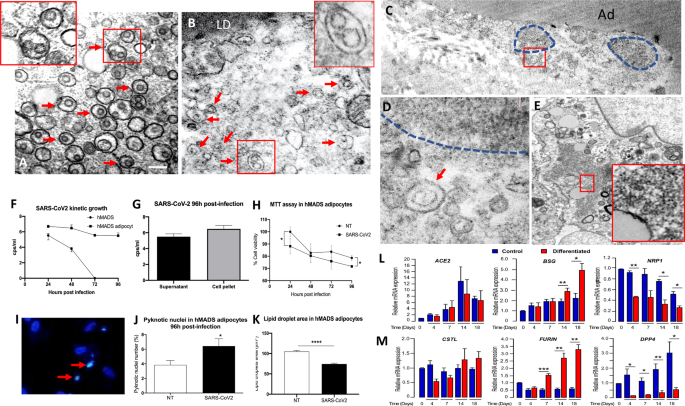
Abbiamo quindi mirato a valutare se le alterazioni dell'IVA osservate fossero associate alla presenza di SARS-CoV-2 nel tessuto o se fossero una conseguenza dell'infiammazione sistemica. Sebbene la capacità di SARS-CoV-2 di infettare il tessuto adiposo umano sia stata spesso speculata [ 8 , 13 , 18 , 23 ], le prove dirette di tale fenomeno sono scarse in letteratura [ 16 , 28 , 29 ]. Mentre l'RNA genomico SARS-CoV-2, le proteine nucleocapside e spike non erano rilevabili nei campioni VAT di pazienti affetti da COVID-19, strutture simili a virus con morfologia e dimensioni simili a quelle presenti nelle cellule VeroE6 infettate da SARS-CoV-2 (Fig. 2A _) sono stati trovati abbastanza spesso nel citoplasma degli adipociti stressati (Fig. 2B ). Inoltre, la presenza di cluster simili a ribosomi descritti nelle cellule infettate da virus [ 30 ] era evidente negli adipociti viscerali di individui con COVID-19, sebbene raramente (Fig. 2 C, D ) e frequentemente in SARS-CoV-2- cellule VeroE6 infettate (24-48 ore dopo l'infezione) (Fig. 2E ). Inoltre, sono stati osservati segni tipici di diverse condizioni patologiche di infezione virale, come cisterne di fronte, complesso lamella ribosomiale e lamelle annulate [ 31 ], in circa il 25% delle cellule IVA appartenenti a soggetti con COVID-19 (Figura 1A-D supplementare) e in circa il 45% delle cellule VeroE6 infettate da SARS-CoV-2 (Figura 1E supplementare ), ma non nei rispettivi controlli non infetti. Successivamente, per fornire prove dirette della capacità di SARS-CoV-2 di infettare gli adipociti umani, portando a stress e morte cellulare, abbiamo infettato gli adipociti multipotenti umani differenziati (hMADS) (Fig. 2F–H ) e valutato la cinetica SARS-CoV-2 in vitro. La cinetica di crescita di SARS-CoV-2 è stata determinata come carica virale (copie/ml) nei supernatanti raccolti dopo 24, 48, 72 e 96 ore dopo l'infezione (Fig. 2F ). Sebbene l'RNA genomico SARS-CoV-2 fosse rilevabile sia negli hMADS differenziati che in quelli indifferenziati nei primi punti temporali dopo l'infezione (24 e 48 ore), potrebbe essere rilevato solo negli adipociti maturi nei punti temporali successivi (72 e 96 ore) ( Figura.2F ). Coerentemente, l'RNA genomico SARS-CoV-2 è stato rilevato anche nel pellet di adipociti hMADS dopo 96 ore di infezione (Fig. 2G ). È importante sottolineare che gli adipociti hMADS infetti hanno mostrato una vitalità cellulare inferiore (Fig. 2H ), una maggiore prevalenza di nuclei picnotici (Fig. 2I -L) e dimensioni delle goccioline lipidiche più piccole, indicative di delipidazione cellulare e stress, rispetto ai controlli non infetti (Fig. 2K ). Inoltre, in linea con questi dati, l'evidenza di una maggiore estrusione di materiale dalle cellule infette rispetto ai controlli non infetti è stata osservata da LM ( p <0,05), suggerendo fortemente una massiccia delipidazione cellulare indotta da SARS-CoV-2 (Figura 1F-H supplementare). Abbiamo quindi eseguito un'analisi temporale dell'espressione hMADS di presunti recettori SARS-CoV-2 (Fig. 2L ) e proteasi (Fig. 2M ) in presenza o assenza del cocktail di differenziazione adipogenica (a 4, 7, 14 e 18 giorni). Il recettore ACE2 è stato espresso a livelli molto bassi sia in hMADS differenziati che indifferenziati, anche se abbiamo utilizzato primer appositamente progettati con un'efficienza del 100,92%. D'altra parte, il recettore BASIGIN è stato rilevato preferenzialmente in hMADS differenziati che hanno mostrato un'espressione aumentata dopo 14 giorni. Il recettore NEUROPILIN 1 è stato espresso da cellule indifferenziate. Per quanto riguarda l'espressione delle proteasi, mentre le hMADS differenziate hanno espresso la proteasiFURIN , gli indifferenziati esprimevano preferenzialmente DPPIV. L'espressione di CATHEPSIN L non differiva tra le due condizioni, mentre non abbiamo rilevato TMPRSS2 in hMADS differenziato e indifferenziato (dati non mostrati).
Una microscopia elettronica a trasmissione (TEM): cellula infetta da VeroE6 che mostra diversi virioni nel reticolo endoplasmatico ruvido (RER), alcuni indicati da frecce. Riquadro: ampliamento della superficie quadrata. B TEM: adipocita dal deposito di tessuto adiposo viscerale (VAT) di un soggetto COVID-19+ che mostra diversi virioni in RER (frecce). Riquadro: ampliamento della superficie quadrata. C TEM: VAT di un soggetto COVID-19+ che mostra un adipocita (Ad) con due grandi cluster simili a ribosomi (linee tratteggiate) nel citoplasma. D L'allargamento dell'area quadrata in C mostra un ammasso simile a un ribosoma e una struttura simile a un virione nella RER dilatata (freccia). E TEM: cellule VeroE6 infettate da SARS-CoV-2 che mostrano un cluster simile a un ribosoma (area quadrata), ingrandito nell'inserto.F Cinetica dell'infezione da SARS-CoV-2 in hMADS indifferenziati e differenziati. RNA genomico SARS-CoV-2 rilevato nel supernatante in diversi momenti espressi come copie (cps)/ml. G SARS-CoV-2 quantificazione in surnatante e pellet cellulari di cellule infettate da hMADS. H Il test di vitalità MTT negli adipociti hMADS mostra una vitalità cellulare inferiore nelle cellule infette rispetto a quelle non infette a 24 e 96 ore dopo l'infezione ( p <0,05). I Colorazione nucleare di Hoechst che mostra i nuclei picnotici (frecce). J Percentuale di nuclei picnotici in hMADS a 96 ore dopo l'infezione rispetto ai controlli non infetti ( p <0,05). K Area media delle goccioline lipidiche (μm 2) in hMADS differenziato 96 h dopo l'infezione rispetto ai controlli non infetti ( p < 0, 0001). Espressione di presunti recettori L di SARS-CoV-2 o proteasi M valutati mediante RT-qPCR e normalizzati per l'espressione dell'mRNA 36B4 . Le espressioni sono state misurate nelle cellule che hanno ricevuto (barre rosse) o non hanno ricevuto (barre blu) il cocktail di differenziazione per il numero di giorni indicato. Le medie ± SEM sono state calcolate da tre esperimenti indipendenti ( ACE2, BSG, NRP1, CSTL ) o quattro esperimenti indipendenti ( FURIN, DPP4 ), con determinazioni eseguite in duplicato (* p <0,05, ** p <0,01). Barra della scala: A , B = 200 nm, C = 500 nm, D = 100 nm, E = 180 nm, F = 120 μm, G = 70 μm, H = 5 μm.
Data la nostra precedente osservazione [ 23 ] e la presenza diffusa di goccioline lipidiche nel lume capillare di VAT e in alcuni depositi adiposi mesenterici, abbiamo studiato la distribuzione dei lipidi nei campioni polmonari impiegando la colorazione Oil Red O (ORO, cioè l'istochimica lipido-specifica). I lipidi sono stati evidenziati all'interno dei setti alveolari dei polmoni, degli spazi interstiziali, delle cellule endoteliali, del lume dei vasi e nei macrofagi alveolari e interstiziali (Fig. 3A-D ), tutte caratteristiche confermate dalla microscopia ottica ed elettronica (Fig. 3E, F ) e suggestive di grasso embolia.
Microscopia ottica A – D (LM): istochimica rappresentativa del grasso (Oil Red O) che mostra la natura lipidica dei vacuoli (rosso-arancione) nel lume vascolare (frecce) e nei setti polmonari di diversi soggetti COVID-19+. E LM: tessuto impregnato di resina, tinto blu toluidina. Grandi goccioline lipidiche libere (gialle) sono evidenti nel lume dei capillari nei setti alveolari (frecce). F Microscopia elettronica a trasmissione (TEM): mostra goccioline lipidiche (LD) in un setto alveolare mescolato con eritrociti. G TEM: macrofago alveolare (M) in un soggetto COVID-19. Nota: reticolo endoplasmatico rugoso dilatato diffuso (RER) che denota stress cellulare (frecce) H TEM: ingrandimento dell'area quadrata in Gmostrando due virioni nelle fasi 1–2 e 5 del ciclo riproduttivo nella RER dilatata simile a quanto osservato in I TEM: (da 1 a 5) fasi del ciclo riproduttivo dei virioni SARS-CoV-2 nelle cellule infette da VeroE6. Riferimento nel testo principale. Barra della scala: A – C = 20 μm, D = 140 μm, E = 8 μm, F = 1,5 μm, G = 1 μm, H = 70 nm, I = 65 nm.
L'embolia grassa nei polmoni non era esclusiva di COVID-19+ ma era più prevalente tra loro rispetto ai controlli (100% vs 53%; p <0,001). I segni di embolia grassa erano infatti più prevalenti tra gli individui con obesità rispetto a quelli con un BMI ≤ 30 kg/m 2 (93% vs 63%, p = 0,03), indipendentemente dalla diagnosi di COVID-19. Coerentemente, tutti i soggetti con diabete di tipo 2 presentavano embolia grassa. Da notare, le osservazioni al microscopio elettronico hanno rivelato diverse strutture con dimensioni e morfologia compatibili con quelle dei virus SARS-CoV-2 [ 6 ] in pneumociti, cellule endoteliali e macrofagi, l'ultimo dei quali mostrava un reticolo endoplasmatico disseminato e dilatato che denota stress cellulare [ 26 , 32] e segni di presenza del virus solo in soggetti con COVID-19 (Fig. 3G, H ). Inoltre, abbiamo raramente evidenziato (in 2 sezioni polmonari su 20 ottenute da 8 COVID-19+) virioni nelle fasi iniziali e tardive del loro ciclo riproduttivo [ 33 ] nel reticolo endoplasmatico dilatato (Fig. 3H ) paragonabili a quelli raramente rivelati in VeroE6 infettato (Fig. 3I ) (5 su ~ 250 cellule). È importante sottolineare che i capillari settali molto spesso contenevano grandi quantità di fibrina, con alcuni di essi rivestiti da materiale trombotico solo nei polmoni degli individui COVID-19+ (dati non mostrati). Diversi corpi di Weibel-Palade, segni di fenomeni coagulativi attivati [ 31], sono stati osservati anche nella maggior parte delle cellule endoteliali capillari di soggetti con COVID-19 (dati non mostrati).
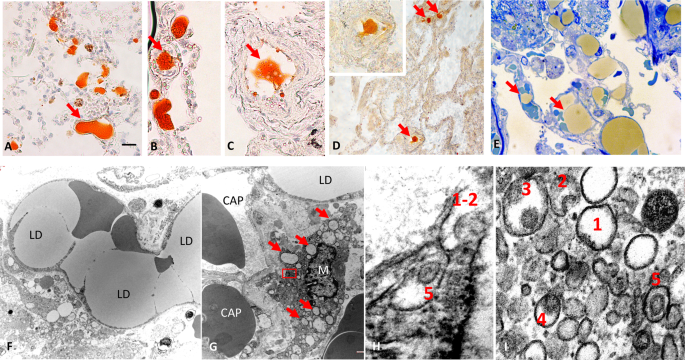
Inaspettatamente, la tecnica istochimica specifica per i lipidi utilizzata ha evidenziato che tutte le strutture alveolari che ricordano HM erano ORO-positive (Fig. 4A ). La presenza di HM è stata quindi confermata da ematossilina ed eosina (H&E), Mallory e colorazione periodica dell'acido-Schiff (dati non mostrati). Tutti i soggetti con COVID-19 hanno presentato ORO + HM nei polmoni, che sono stati rilevati solo in un soggetto di controllo (BMI 21,3 kg/m2 ) che è morto di polmonite ( p <0,0001). È interessante notare che quest'ultimo soggetto ha mostrato una debole positività HM per la colorazione ORO, suggerendo una presenza lipidica inferiore. Questo risultato è coerente con altri rapporti che descrivono l'HM nei polmoni di pazienti con polmonite non correlata a COVID-19 [ 7]. È importante sottolineare che le goccioline lipidiche ORO + e i macrofagi ricchi di lipidi erano spesso racchiusi nell'HM che rivestono la superficie alveolare (Fig. 4B-D ). Sono stati osservati diversi aspetti che suggeriscono un ruolo diretto del grasso embolico nella formazione di HM. In particolare, sono state osservate goccioline lipidiche libere che occupano lo spazio alveolare e rivestono e si diffondono sulla superficie alveolare (Fig. 4E-H ). La presenza di HM del polmone di natura lipidica era associata all'infiammazione dell'IVA (8,0 ± 5,4 vs 3,7 ± 1,8 CD68+ macrofagi/10 adipociti in soggetti con e senza HM, rispettivamente) ed escludeva i casi di COVID-19+ (Figura 2 supplementare ).
A Microscopia ottica (LM): membrane ialine che rivestono le superfici alveolari (frecce) a basso ingrandimento. B LM: ingrandimento dell'area quadrata in A che mostra la natura microvacuolare di ORO + membrana ialina (freccia blu). Macrofagi ricchi di lipidi liberi nello spazio alveolare (frecce rosse) e all'interno delle membrane ialine (freccia rossa). C LM: aspetto vacuolare di ORO + lipidi delle membrane ialine (freccia e area quadrata). D LM: ampliamento dell'area quadrata in C . Le frecce indicano vacuoli lipidici. E LM: ORO + grande vacuolo lipidico libero che riveste la superficie alveolare (freccia rossa) vicino a una membrana ialina (freccia blu). FTEM: goccioline lipidiche libere che rivestono la superficie alveolare composte da pneumociti di tipo II (PT2) con classici granuli di tensioattivo (freccia). G LM: ORO + vacuolo lipidico che si diffonde sulla superficie alveolare (possibile fase iniziale di diffusione dei lipidi). H LM: ORO + vacuoli lipidici che possono contribuire allo sviluppo delle membrane ialine (stadio successivo). Barra della scala: A , E = 50 μm, B = 7 μm, C = 10 μm, D = 2 μm, F = 3 μm, G = 25 μm, H = 35 μm.
Infine, poiché il materiale embolico dei tessuti viscerali addominali dovrebbe necessariamente passare attraverso il parenchima epatico per raggiungere il polmone, abbiamo sfruttato la tecnica di colorazione ORO per studiare campioni di fegato appartenenti a 9 individui con COVID-19 e 8 soggetti di controllo. I campioni autoptici del fegato hanno mostrato una steatosi focale macrovescicolare con goccioline lipidiche di dimensioni molto variabili (Figura 3A supplementare ), coerente con altri studi condotti su pazienti con COVID-19 [ 34 ]. In particolare, segni coerenti con l'embolia grassa, cioè la presenza di goccioline lipidiche libere nelle sinusoidi epatiche (Figura 3B supplementare ) e nel lume dei vasi (Figura 3C, D supplementare ), nonché ammassi di strutture ricche di lipidi nel portale vena (supplementare Fig.3D ) sono stati osservati nel gruppo COVID-19+, un risultato che ha confermato la natura embolica delle goccioline di grasso epatico e che supporta quanto osservato nei campioni IVA. In sintesi, 8/9 COVID-19+ con embolia grassa polmonare documentata mostrava anche segni di embolia grassa epatica. D'altra parte, abbiamo osservato embolia epatica in un'alta percentuale di controlli (6/8), probabilmente a causa dell'elevata prevalenza di obesità viscerale tra questi casi studiati.
Discussione
Questo è il primo studio che indaga le caratteristiche ultrastrutturali dell'IVA tra individui con COVID-19 e che valuta la distribuzione dei lipidi nei polmoni e nei campioni di fegato per istomorfologia. I nostri dati supportano la presenza di una maggiore infiammazione dell'IVA locale e una maggiore prevalenza di embolia grassa e formazioni lipidiche di HM nei polmoni di soggetti morti a causa di COVID-19 rispetto ai soggetti di controllo morti per motivi diversi. Inoltre, i nostri dati supportano la capacità di SARS-CoV-2 di infettare gli adipociti umani in vitro.
Considerando la forte associazione tra complicanze legate al COVID-19 e obesità, in particolare con eccesso di contenuto adiposo viscerale [ 10 , 11 , 13 , 14 , 15 , 16 ], la comprensione del fenomeno biologico alla base di tale associazione ha implicazioni cliniche critiche nell'era della pandemia di COVID-19.
Il nostro studio fornisce la prima prova di una maggiore infiammazione locale dell'IVA tra i soggetti con COVID-19, indipendentemente dallo stato di obesità e supporta un'esacerbazione dell'infiammazione correlata all'obesità da parte dell'infezione da SARS-CoV-2, una nuova scoperta coerente con gli studi che riportano una maggiore infiammazione sistemica tra pazienti infetti [ 18 ]. L'infiammazione degli adipociti è associata a stress cellulare, morte e rilascio di lipidi nello spazio extracellulare [ 19 , 20 , 25 , 26]. Abbiamo quindi studiato le caratteristiche degli adipociti mediante TEM e rivelato la presenza dei segni tipici dello stress cellulare, insieme alle caratteristiche prominenti del trasferimento di lipidi dagli adipociti sofferenti. Da notare, questi dati sono supportati da un recente lavoro che mostra un aumento del numero di anticorpi autoimmuni contro la malondialdeide e l'antigene proteico derivato dagli adipociti (marcatori di perossidazione lipidica e morte degli adipociti, rispettivamente [ 35 ]) tra soggetti con COVID-19 e obesità rispetto agli individui che soffrono di ciascuna condizione in modo indipendente [ 36 ]. Inoltre, è stato dimostrato che l'iperglicemia tra i soggetti con COVID-19 è fortemente associata all'insulino-resistenza e ai bassi livelli plasmatici di adiponectina [ 29]. Gli autori dello stesso studio hanno anche dimostrato che SARS-CoV-2 potrebbe infettare il tessuto adiposo del criceto, portando a una riduzione della produzione di adiponectina e ipotizzato che l'infezione da SARS-CoV-2 potrebbe provocare una disfunzione degli adipociti che determina la resistenza all'insulina.
È importante sottolineare che abbiamo rilevato lipidi nello spazio extracellulare, all'interno delle cellule endoteliali, all'interno del lume capillare e l'estrusione dalle cellule endoteliali nel lume capillare, tutte caratteristiche indicative di embolia grassa. Sebbene le strutture simili a virus siano state evidenziate da TEM negli stessi depositi IVA, la mancanza di rilevamento di SARS-CoV-2 mediante qPCR non ci ha permesso di concludere che tale infiammazione, stress cellulare e morte fossero tutti correlati alla presenza del virus . È, infatti, possibile che le caratteristiche dell'IVA descritte fossero secondarie all'infiammazione sistemica indotta da COVID-19 o dovute alla presenza di diversi virus all'interno del deposito. Dall'altro lato, abbiamo dimostrato che SARS-CoV-2 potrebbe infettare gli adipociti umani anche se né gli adipociti né i progenitori degli adipociti hanno raccolto tutti i requisiti molecolari noti per l'ingresso del virus (ad es. espressione di tutte le proteasi e recettori virali conosciuti). Questo insieme di dati è in parte coerente con altri risultati e suggerisce che ulteriori, non ancora caratterizzati, recettori e proteasi possono essere sfruttati per questo scopo [16 , 37 ]. Puray-Chavez et al. infatti ha indicato che le cellule di adenocarcinoma polmonare umano H522 sono permissive all'infezione da SARS-CoV-2 nonostante la completa assenza di ACE2 e che l'ingresso del virus dipende dall'eparan solfato in questa linea cellulare [ 37 ]. È importante sottolineare che, nonostante siano i primi bersagli SARS-CoV-2, le cellule epiteliali olfattive e respiratorie esprimono bassi livelli di proteina ACE2 [ 38 ]. Per questi motivi, ulteriori cofattori che facilitano l'interazione tra virus e cellula ospite (ad es. NEUROPILIN-1 [ 39 , 40 ]) possono essere critici per l'infezione di tessuti che esprimono bassi livelli di ACE2. Nel nostro studio, recettore BASIGIN e FURIN la proteasi era altamente espressa in hMADS differenziati e potrebbe essere sfruttata per l'infezione da SARS-CoV-2. Tuttavia, va notato che, sebbene il ruolo critico di FURIN nella mediazione dell'infezione da SARS-CoV-2 sia ampiamente accettato e sembri rilevante nei pazienti con diabete di tipo 2 in cui la proteasi è altamente espressa [ 41 ], il ruolo di BASIGIN ha è stato recentemente interrogato [ 42 ].
Data la presenza diffusa di goccioline lipidiche nel lume capillare di VAT e i nostri dati preliminari [ 23 ], abbiamo studiato la distribuzione dei lipidi nei campioni di polmone e fegato e abbiamo confermato la presenza di embolia grassa. È interessante notare che abbiamo notato strutture simili a lipidi anche nelle immagini del polmone di altri rapporti su pazienti con COVID-19 [ 5 , 6 , 43 ], motivo per cui riteniamo valga la pena eseguire ulteriori analisi approfondite sui campioni disponibili.
L'embolia grassa nei polmoni non era esclusiva, ma più diffusa tra i soggetti con COVID-19; è stato infatti rilevato anche tra soggetti con obesità indipendentemente dall'infezione da SARS-CoV-2. Questi dati non sono sorprendenti dato che la morte degli adipociti e il rilascio di lipidi sono entrambi fenomeni che si verificano nell'obesità [ 19 , 25 , 26 ]. Questo risultato fornisce la prima prova che indica l'embolia grassa come una complicazione dell'obesità (e dell'obesità più il diabete di tipo 2), determinata dalla morte degli adipociti e forse esacerbata dallo stato infiammatorio indotto da COVID-19. È importante sottolineare che, studiando l'accumulo di lipidi nel polmone, abbiamo inaspettatamente rivelato la presenza di HM lipidico, una formazione fortemente contribuente/associata alla fibrosi interstiziale e alla polmonite correlate a COVID-19.6 ]. HM erano presenti in tutti i pazienti con COVID-19 e in un solo controllo morto per polmonite, un risultato coerente con altri rapporti che descrivono la presenza di HM in quest'ultima malattia [ 7 ]. La nostra valutazione istomorfologica ha rivelato diversi aspetti indicativi di un ruolo diretto del grasso embolico nella formazione di HM. Coerentemente, la presenza di HM polmonare di natura lipidica (nei polmoni) era associata ad infiammazione della VAT.
I nostri risultati sull'embolia grassa intestinale ed epatica supportano fortemente la natura embolica delle goccioline lipidiche nei polmoni. Poiché il sistema portale drena il sangue venoso dalla maggior parte dei depositi di grasso addominale al fegato, il grasso embolico originato nell'IVA passa necessariamente attraverso il fegato per raggiungere altri organi. La presenza inequivocabile di goccioline lipidiche nelle sinusoidi e nelle vene epatiche supporta la produzione di grasso embolico da parte del grasso addominale.
In sintesi, nella nostra casistica, sebbene l'embolia grassa possa essere presente nell'obesità e nel diabete di tipo 2 indipendentemente da COVID-19, il materiale lipidico embolico potrebbe contribuire alla formazione di HM solo nel caso di polmonite correlata a COVID-19. Questa nuova scoperta ha implicazioni cliniche critiche e merita ulteriori indagini. Inoltre, questi dati forniscono informazioni sulla natura HM, poiché il loro processo di formazione non è stato ancora caratterizzato [ 44 ]. Sono necessari ulteriori studi che indaghino sulla natura HM della polmonite non correlata a COVID-19 per dettagliare tali caratteristiche istopatologiche.
Collettivamente i nostri dati rivelano una maggiore infiammazione locale dell'IVA nei soggetti con capacità di COVID-19 e SARS-CoV-2 di infettare gli adipociti umani. Inoltre, forniamo le prime prove che supportano l'embolia grassa come complicanza dell'obesità, probabilmente determinata dalla morte degli adipociti ed esacerbata dallo stato infiammatorio indotto da COVID-19. Infine, riveliamo per la prima volta la presenza dell'HM lipidico del polmone tra tutti i soggetti infetti, una nuova caratteristica istopatologica correlata al COVID-19 associata all'infiammazione dell'IVA e all'embolia grassa. Coerentemente, l'embolia grassa mostra segni e sintomi simili a quelli osservati in COVID-19, in linea con un caso clinico pubblicato di recente [ 45]. Quando si sospetta embolia grassa e COVID-19, la diagnosi differenziale è fondamentale per un'adeguata cura del paziente. Sulla base dei nostri risultati, la valutazione dei sintomi dell'embolia grassa è obbligatoria nel contesto della pandemia di COVID-19, in particolare tra i pazienti con sintomi polmonari, obesità e circonferenza della vita alta, gli ultimi due dei quali sono riconosciuti come segni di elevato accumulo adiposo viscerale . Tale stato clinico complesso dovrebbe quindi essere adeguatamente valutato e adeguatamente affrontato. I nostri dati hanno implicazioni cliniche critiche nel contesto dell'obesità e delle pandemie di COVID-19 e devono essere confermati da ulteriori studi con una dimensione del campione più ampia.
Materiali e metodi
Approvazione dello studio
Abbiamo seguito il rapporto “Etica della ricerca durante la pandemia di COVID-19: studi osservazionali, e in particolare epidemiologici” pubblicato dall'Istituto Superiore di Sanità italiano nel maggio 2020 (Rapporto ISS COVID-19, n. 47/2020) [ 46 ]. Dato che il nostro studio era di natura osservazionale (trasversale, caso-controllo), ed è stato condotto su campioni autoptici e non ha comportato né un intervento, né la raccolta di informazioni sensibili del soggetto, non abbiamo ottenuto un consenso informato. Il nostro studio non ha comportato alcun rischio fisico per i soggetti. In Italia la valutazione degli studi osservazionali non farmacologici non è regolata dagli stessi riferimenti normativi previsti per la valutazione degli studi clinici e degli studi osservazionali sui farmaci. Inoltre, come riportato nella relazione di cui sopra [46 ] nella sezione dedicata al nostro tipo di studio in condizioni di pandemia e quindi ad alto rischio per le comunità, alcuni passaggi amministrativi potrebbero essere aboliti. Pertanto, il nostro Institutional Review Board non richiede l'approvazione etica per gli studi condotti su campioni autoptici e che non raccolgono dati personali o sensibili.
Materie di studio e campionamento dei tessuti
Tra marzo 2020 e maggio 2021 sono stati raccolti campioni autoptici di polmone, fegato e IVA di 49 soggetti presso il Dipartimento di Medicina Legale degli Ospedali Riuniti di Ancona. Ventiquattro soggetti sono stati affetti da COVID-19, mentre i restanti 25 no e morì per diversi motivi. L'infezione da SARS-CoV-2 è stata valutata in tutti i soggetti mediante test RT-PCR su tampone nasofaringeo. I soggetti sono stati inclusi nelle analisi solo se i campioni dei loro polmoni erano ben conservati in modo tale da poter eseguire una valutazione istologica di alta qualità. Abbiamo quindi analizzato 19 casi COVID-19+ e 23 controlli. Tra i soggetti studiati, 15 avevano condizioni respiratorie documentate, ovvero polmonite, dispnea, distress respiratorio (10 controlli COVID-19+ e 5 controlli), 15 avevano ipertensione documentata (7 controlli COVID-19+ e 8 controlli), 11 avevano il diabete di tipo 2 (6 COVID-19+ e 5 controlli) e 10 soffrivano di malattie cardiovascolari (2 COVID-19+ e 8 controlli). L'IVA è stata prelevata dalla regione dell'omento e del mesentere. I polmoni sono stati ampiamente campionati nelle regioni centrali e periferiche di ciascun lobo bilateralmente. Una mediana di sette blocchi di tessuto (intervallo da cinque a nove) è stata prelevata da ciascun polmone. Campioni di fegato sono stati raccolti dai lobi destro e sinistro.
I campioni sono stati tagliati in pezzi diversi per essere studiati mediante LM e microscopia elettronica a trasmissione (TEM). Una descrizione metodologica completa per tali metodologie è stata descritta altrove [ 47 ].
Immunoistochimica e analisi morfometriche
Le autopsie del tessuto adiposo viscerale (omentale) raccolte, del polmone e del fegato sono state fissate durante la notte a 4 ° C in paraformaldeide al 4%. I campioni sono stati quindi incorporati in paraffina per essere studiati da LM ed eseguire analisi immunoistochimiche e morfometriche. Per ogni campione sono state ottenute sezioni di paraffina da 3 µm e utilizzate per analisi immunoistochimiche. Una descrizione completa del protocollo è stata descritta altrove [ 47]. Per rilevare la presenza di macrofagi CD68+ nei campioni VAT, abbiamo utilizzato l'anticorpo CD68 (Dako # M0814; diluizione 1:200; metodo di recupero dell'antigene con tampone citrato pH6). Per studiare la presenza di SARS-CoV-2 in VAT, abbiamo utilizzato il nucleocapside SARS-CoV-2 (Invitrogen #MA-17404) e gli anticorpi della proteina spike (Sino Biological #40150-T62) a diverse diluizioni. Gli stessi anticorpi sono stati utilizzati per rilevare il virus su VeroE6 infetto alla diluizione: 1:1000 per la proteina nucleocapside e 1:100 per la proteina spike. Il controllo negativo in cui è stato omesso l'anticorpo primario è stato sempre incluso in ciascuna serie di reazioni per valutare la specificità dell'anticorpo. Le sezioni di tessuto sono state osservate con un microscopio ottico Nikon Eclipse E800. Per scopi morfometrici, per ciascuna sezione di paraffina, sono state acquisite dieci immagini digitali con ingrandimento ×20 con una fotocamera Nikon DXM 1220. In tutte le immagini sono stati contati i macrofagi CD68+ diffusi nel parenchima IVA e organizzati per formare CLS. Per ogni soggetto, il numero di macrofagi totali e la densità di CLS/104 adipociti sono stati contati con il programma morfometrico ImageJ (RRID:SCR_003070). L'area degli adipociti è stata misurata in tutti i pazienti contando 100 adipociti per ciascuna sezione di tessuto di paraffina utilizzando ImageJ.
Colorazione istochimica
Per la colorazione ORO, i campioni sono stati crioprotetti in saccarosio al 30% durante la notte, incorporati nel mezzo composto per la temperatura di taglio ottimale e quindi affettati per ottenere criosezioni spesse 7 μm dal criostato Leica CM1900 (Vienna, Austria). La colorazione ORO è stata quindi eseguita su criosezioni di polmoni [ 43 ] e fegato ( n = 9). In breve, le criosezioni essiccate sono state prima poste in isopropanolo al 60%, quindi in soluzione di lavoro ORO filtrata (15 min a temperatura ambiente) e nuovamente lavate brevemente in isopropanolo al 60% e infine in H 2O. Le fette di tessuto sono state quindi colorate di contrasto con ematossilina e ricoperte con un vetrino coprioggetto utilizzando il mezzo di montaggio Vectashield (Vector Laboratories). L'organizzazione e la morfologia dei tessuti del polmone e del fegato sono state studiate anche mediante colorazione H&E su sezioni di paraffina. La presenza e la caratterizzazione dell'HM del polmone sono state eseguite su sezioni di paraffina mediante colorazione H&E, acido periodico di Schiff e tricoma di Masson.
Microscopia elettronica a trasmissione
Per le analisi ultrastrutturali, i campioni di 3 mm di spessore di VAT ( n = 4), polmone ( n = 8) e fegato ( n = 1) sono stati ulteriormente fissati in glutaraldeide al 2% e paraformaldeide al 2% in tampone fosfato 0,1 M (pH 7,4) e post-fissato in tetrossido di osmio all'1%, quindi incorporato in resina epossidica per studi TEM come descritto altrove [ 47 ]. I pellet cellulari degli studi in vitro sono stati fissati in modo simile in glutaraldeide al 2% e paraformaldeide al 2% in tampone fosfato 0,1 M (pH 7,4) per 1 ora a temperatura ambiente e quindi incorporati in resina epossidica. Un ultratomo MT-X (RMC; Tucson) è stato utilizzato per ottenere sezioni ultrasottili (~ 70 nm). La caratterizzazione ultrastrutturale è stata eseguita su tutti i campioni utilizzando un microscopio elettronico a trasmissione Philips CM10 (Philips, Eindhoven, Paesi Bassi,http://www.usa.philips.com ).
Infezione da SARS-CoV-2 in VeroE6
Le cellule VeroE6 sono state coltivate nel mezzo Eagle modificato di Dulbecco (Euroclone, Milano, Italia), integrato con siero fetale di vitello al 10% (FCS Euroclone) e antibiotici/antimicotici (100 U/ml di penicillina, 100 µg/ml di streptomicina, 0,25 µg/ml di amfotericina B) a 37 °C, 5% CO 2 in atmosfera umidificata (90%), come descritto in precedenza [ 48 ]. Le cellule sono state mantenute in flaconi di coltura tissutale da 75 cm 2 . Il giorno prima dell'infezione, un monostrato confluente è stato tripsinizzato e 1,5 × 10 6 cellule sono state seminate in ogni otto flaconi (25 cm 2 ). I monostrati confluenti sono stati infettati da SARS-CoV-2 (78952 isolati, numero di accesso MT483867) [ 49 ] con una molteplicità di infezione di 3,29 ∙ 10 5. Dopo 2 h di incubazione, il mezzo contenente l'inoculo è stato rimosso, le cellule sono state lavate due volte ed è stato aggiunto terreno fresco, che è stato raccolto dopo 6, 12, 24 e 48 h per la quantificazione del genoma virale e sostituito con 2 ml di fresco terreno di coltura per consentire la raschiatura del monostrato infetto. I controlli monostrato cellulari non infetti sono stati trattati come infetti. Le sospensioni cellulari (2 ml) sono state successivamente centrifugate a 800 rpm per 5 minuti. Aliquote di supernatanti infetti, raccolte come sopra, sono state analizzate utilizzando il test RT-qPCR come descritto altrove [ 49]. In breve, 5 µl di RNA estratti da 140 µl di surnatanti infetti sono stati analizzati insieme a una curva di calibrazione, ottenuta da diluizioni dieci volte di un plasmide standard certificato e quantificato da un fornitore (2019-nCoV Positive Control, nCoVPC, 85 IDT) e controllo negativo, applicando un protocollo descritto da CDC ( https://www.fda.gov/media/134922/download ).
Studi in vitro su hMADS
Approvazione etica
I progenitori degli adipociti umani -Aps- (cellule hMADS) sono stati isolati dal tessuto adiposo, come frammenti chirurgici da un campione chirurgico di vari interventi chirurgici di giovani donatori, con il consenso informato dei genitori. Tutti i metodi sono stati approvati ed eseguiti seguendo le linee guida e i regolamenti del Center Hospitalier Universitaire de Nice Review Board.
Differenziazione cellulare
Le cellule hMADS sono state mantenute e differenziate come descritto in precedenza [ 50 ]. Saranno inoltre indicati come adipociti hMADS. Sono stati regolarmente testati per l'assenza di micoplasma. Trattamenti e saggi biologici sono stati eseguiti in duplicato su cellule hMADS di controllo o differenziate dal giorno 4 al giorno 18.
Analisi dell'espressione genica
L'RNA totale è stato estratto utilizzando il kit TRI-Reagent (Euromedex, Soufflweyersheim, Francia) e la trascrizione inversa (RT) è stata eseguita utilizzando la trascrittasi inversa MMLV (Promega, Charbonnieres, Francia), come raccomandato dai produttori. Tutte le sequenze di primer sono descritte nella sezione Supplementare. I saggi PCR in tempo reale sono stati eseguiti su una macchina PCR in tempo reale ABI Prism One-step (Applied Biosystems, Courtaboeuf, Francia). La normalizzazione è stata eseguita utilizzando 36B4 come gene di riferimento. La quantificazione è stata eseguita utilizzando il metodo Ct comparativo. I risultati sono mostrati come media ± errore standard della media (SEM), con il numero di esperimenti indicato. La significatività statistica è stata determinata da t-test BiostaTGV (INSERM e Università della Sorbona, PARIGI, Francia). I valori di probabilità < 0,05 sono stati considerati statisticamente significativi e sono contrassegnati da un singolo asterisco, <0,01 con doppi asterischi e <0,001 con tripli asterischi. Sequenze per i primer utilizzati in questo studio ACE2 (FW 5′- AGAACCCTGGACCCTAGCAT -3′; REV 5′- AGTCGGTACTCCATCCCACA -3′); BASIGIN (AV: 5′- CAGAGTGAAGGCCGTGAAGT -3′; REV: 5′- ACTCTGACTTGCAGACCAGC -3′); NRP1 (AV: 5′- GGGGCTCTCACAAGACCTTC -3′; REV: 5′- GATCCTGAATGGGTCCCGTC -3′); CSTL (AV: 5′- CTGGTGGTTGGCTACGGATT -3′; REV: 5′- CTCCGGTCTTTGGCCATCTT -3′); FURIN (FW: 5′-CTACAGCAGTGGCAACCAGA-3′; REV: 5′- TGTGAGACTCCGTGCACTTC-3′); 36B4 (AV:5′- CTACAACCCTGAAGAAGTGCTTG -3′; REV: 5′- CAATCGCAGACAGACACTGG -3′); DPP4 (SINO biologicos Inc. #HP100-649 (Eschborn, Germania)
Infezione da hMADS SARS-CoV-2
Le cellule degli adipociti hMADS e hMADS sono state infettate con uno stock virale di SARS-CoV-2 (EPI_ISL_417491), a una dose infettiva di coltura tissutale del 50% (TCID 50 ) di 2000 TCID 50 / ml per 2 ore a una temperatura di 37 ° C. Dopo l'incubazione, il mezzo contenente l'inoculo è stato rimosso, le cellule sono state lavate due volte e il mezzo è stato integrato con diversi composti specifici. I surnatanti sono stati raccolti a 24, 48, 72, 96 ore per la quantificazione del genoma virale ed è stato eseguito il rinnovo del mezzo ad ogni tempo di campionamento. I controlli del monostrato cellulare non infetto sono stati trattati come quelli infetti. I surnatanti, raccolti come sopra e i pellet cellulari, raccolti a 96 ore dall'infezione, sono stati analizzati utilizzando RT-qPCR come descritto nella sezione delle cellule VeroE6.
Test di vitalità cellulare (test MTT)
L'effetto dell'infezione da SARS-CoV-2 sulla vitalità cellulare degli adipociti hMADS è stato misurato utilizzando il colorante metabolico [4,5-dimetiltiazol-2-il]-2,5-difenil tetrazolio (MTT) (Sigma, St. Louis, MO , STATI UNITI D'AMERICA). In breve, le cellule hMADS sono state seminate in piastre da 96 pozzetti ad una densità di 4500 cellule/cm 2, differenziato e quindi infettato con lo stock virale di SARS-CoV-2 per 2 ore a 37 °C. Dopo l'incubazione con il virus, le cellule sono state poste in un mezzo integrato. Le analisi temporali della sopravvivenza cellulare sono state determinate a 24, 48, 72 e 96 ore. Dopo il periodo di incubazione, i mezzi sono stati sostituiti con 100 µl di MTT (0,5 mg/ml), disciolti in PBS e incubati per 3 h. Il mezzo contenente MTT è stato rimosso e sono stati aggiunti 100 μl di dimetilsolfossido per dissolvere i cristalli di formazano formati da cellule vive. L'assorbanza è stata successivamente misurata a 570 nm utilizzando un lettore di micropiastre BioTek Synergy HTX (BioTek, Winooski, VT, USA). I risultati sono stati espressi come percentuali di cellule vitali rispetto ai controlli non infetti.
Analisi della morfologia nucleare
Le alterazioni nella morfologia nucleare sono state determinate mediante valutazione della colorazione nucleare mediante coloranti fluorescenti e microscopia fluorescente [ 51 ].
Per questi esperimenti, gli adipociti hMADS sono stati differenziati in vetrini da camera Lab-Tek a 2 pozzetti (Nalge Nunc International, Naperville, IL, USA), lavati con PBS pH 7,4 e fissati con paraformaldeide al 10% in PBS per 10 minuti a temperatura ambiente. Dopo il lavaggio con PBS, la colorazione nucleare è stata eseguita con Hoechst. Infine, le cellule sono state asciugate all'aria e ricoperte utilizzando il mezzo di montaggio Vectashield (Vector Laboratories, Burlingame, CA, USA) e analizzate mediante microscopia a fluorescenza. Il numero di nuclei alterati è stato contato (nel campo che mostra la frammentazione nucleare e la condensazione nucleare) e diviso per il numero totale di nuclei moltiplicato per 100. Le osservazioni sono state eseguite da Lucia IMMAGINE 4.82, Laboratory Investigations Morphometric Analyses.
La dimensione delle goccioline lipidiche (μm 2 ) è stata misurata negli adipociti hMADS infetti da SARS-CoV-2 e nei controlli non trattati. A tale scopo, abbiamo utilizzato una tavoletta grafica e un programma morfometrico (Nikon LUCIA IMAGE, Laboratory Imaging, versione 4.61; Praha, Repubblica Ceca). Gli adipociti hMADS sono stati esaminati con un microscopio a luce invertita Nikon Eclipse Ti-S (Nikon Instruments SpA, Calenzano, Italia) e le immagini digitali sono state acquisite a ×20 con una fotocamera Nikon DS-L2 (Nikon Instruments SpA, Calenzano, Italia). Sono stati analizzati cinque campi casuali, sono state misurate almeno 1700 goccioline lipidiche per ciascun campione e la differenza tra cellule infette e non infette è stata valutata da t spaiati-test. Allo stesso modo, la valutazione quantitativa del materiale estruso dall'hMADS è stata calcolata utilizzando lo stesso microscopio e software ed è stata espressa come numero di vacuoli estrusi dalle cellule sulla quantità totale di cellule.
Analisi statistica
I confronti tra i gruppi per le variabili lineari e categoriali sono stati determinati rispettivamente dal test t di Student a due code e dal test del chi quadrato spaiati. Le differenze di gruppo sono state considerate significative quando p < 0,05. I dati nei grafici sono espressi come media ± SEM. Le analisi statistiche sono state eseguite con Prism 6.0 (GraphPad Software Inc., La Jolla, CA) e IBM SPSS Statistics Data Editor (v.24).
Riferimenti
- 1.
Medicina JHU. Centro risorse per il coronavirus. 2021. https://coronavirus.jhu.edu/map.html .
- 2.
Mahendra M, Nuchin A, Kumar R, Shreedhar S, Mahesh PA. Predittori di mortalità nei pazienti con polmonite grave da COVID-19: uno studio retrospettivo. Avv. Respir Med. 2021;89:135–44.
- 3.
Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Caratteristiche cliniche dei pazienti infettati dal nuovo coronavirus del 2019 a Wuhan, in Cina. Lancetta. 2020;395:497–506.
- 4.
Wadman M, Couzin-Frankel J, Kaiser J, Matacic C. Una furia attraverso il corpo. Scienza. 2020;368:356–60.
- 5.
Xu Z, Shi L, Wang Y, Zhang J, Huang L, Zhang C, et al. Reperti patologici di COVID-19 associati alla sindrome da distress respiratorio acuto. Lancetta Respir Med. 2020;8:420–2.
- 6.
Bradley BT, Maioli H, Johnston R, Chaudhry I, Fink SL, Xu H, et al. Istopatologia e risultati ultrastrutturali di infezioni fatali da COVID-19 nello Stato di Washington: una serie di casi. Lancetta. 2020;396:320–32.
- 7.
Schneider JL, Rowe JH, Garcia-de-Alba C, Kim CF, Sharpe AH, Haigis MC. Il polmone che invecchia: fisiologia, malattia e immunità. Cellula. 2021;184:1990–2019.
- 8.
Stefan N, Birkenfeld AL, Schulze MB. Pandemie globali interconnesse: obesità, compromissione della salute metabolica e COVID-19. Nat Rev Endocrinolo. 2021;17:135–49.
- 9.
O'Hearn M, Liu J, Cudhea F, Micha R, Mozaffarian D. Coronavirus Disease 2019 ricoveri attribuibili a condizioni cardiometaboliche negli Stati Uniti: un'analisi comparativa della valutazione del rischio. J Am Heart Assoc. 2021;10:e019259.
- 10.
Williamson EJ, Walker AJ, Bhaskaran K, Bacon S, Bates C, Morton CE, et al. Fattori associati alla morte correlata a COVID-19 utilizzando OpenSAFELY. Natura. 2020;584:430–6.
- 11.
Onder G, Palmieri L, Vanacore N, Giuliano M, Brusaferro S, Istituto Superiore di Sanità C-MG. Complicanze non respiratorie e obesità nei pazienti che muoiono con COVID-19 in Italia. Obesità. 2021;29:20–3.
- 12.
Locke AE, Kahali B, Berndt SI, Justice AE, Pers TH, Day FR, et al. Gli studi genetici sull'indice di massa corporea forniscono nuove intuizioni per la biologia dell'obesità. Natura. 2015;518:197–206.
- 13.
Battisti S, Pedone C, Napoli N, Russo E, Agnoletti V, Nigra SG, et al. La tomografia computerizzata evidenzia un aumento dell'adiposità viscerale associata a malattie critiche in COVID-19. Cura del diabete. 2020;43:e129–30.
- 14.
Watanabe M, Caruso D, Tuccinardi D, Risi R, Zerunian M, Polici M, et al. Il grasso viscerale mostra l'associazione più forte con la necessità di terapia intensiva nei pazienti con COVID-19. Metabolismo. 2020;111:154319.
- 15.
Petersen A, Bressem K, Albrecht J, Thiess HM, Vahldiek J, Hamm B, et al. Il ruolo dell'adiposità viscerale nella gravità di COVID-19: punti salienti di uno studio pilota trasversale unicentrico in Germania. Metabolismo. 2020;110:154317.
- 16.
Drucker DJ. Diabete, obesità, metabolismo e infezione da SARS-CoV-2: la fine dell'inizio. Metabolismo cellulare 2021;33:479–98.
- 17.
Kompaniyets L, Goodman AB, Belay B, Freedman DS, Sucosky MS, Lange SJ, et al. Indice di massa corporea e rischio di ricovero correlato a COVID-19, ricovero in unità di terapia intensiva, ventilazione meccanica invasiva e morte — Stati Uniti, marzo-dicembre 2020. Morb Mortal Wkly Rep. 2021;70:355–61.
- 18.
Morys F, Dagher A. La scarsa salute metabolica aumenta la mortalità correlata a COVID-19 nel campione di biobanca britannica. Endocrino anteriore. 2021;12:652765.
- 19.
Cinti S, Mitchell G, Barbatelli G, Murano I, Ceresi E, Faloia E, et al. La morte degli adipociti definisce la localizzazione e la funzione dei macrofagi nel tessuto adiposo di topi e esseri umani obesi. J Lipid Res. 2005;46:2347–55.
- 20.
Hotamisligil GS. Infiammazioni, metafiammazioni e disordini immunometabolici. Natura. 2017;542:177–85.
- 21.
Colleluori G, Villareal DT. Invecchiamento, obesità, sarcopenia e l'effetto dell'intervento di dieta ed esercizio fisico. Esp Gerontolo. 2021;155:111561.
- 22.
Gupte M, Boustany-Kari CM, Bharadwaj K, Police S, Thatcher S, Gong MC, et al. ACE2 è espresso negli adipociti del topo e regolato da una dieta ricca di grassi. Am J Physiol Regul Integr Comp Physiol. 2008;295:R781–8.
- 23.
Cinti S, Graciotti L, Giordano A, Valerio A, Nisoli E. COVID-19 ed embolia grassa: un'ipotesi per spiegare l'esito clinico grave nelle persone con obesità. Int J Obes. 2020;44:1800–2.
- 24.
Shin J, Toyoda S, Nishitani S, Fukuhara A, Kita S, Otsuki M, et al. Possibile coinvolgimento del tessuto adiposo in pazienti con età avanzata, obesità e diabete con infezione da Coronavirus SARS-CoV-2 (COVID-19) tramite GRP78 (BIP/HSPA5): significato della gestione dell'iperinsulinemia in COVID-19. Diabete. 2021;70:2745–2755.
- 25.
Murano I, Barbatelli G, Parisani V, Latini C, Muzzonigro G, Castellucci M, et al. Gli adipociti morti, rilevati come strutture a forma di corona, sono prevalenti nei depositi di grasso viscerale di topi geneticamente obesi. J Lipid Res. 2008;49:1562–8.
- 26.
Camastra S, Vitali A, Anselmino M, Gastaldelli A, Bellini R, Berta R, et al. Morfologia muscolare e del tessuto adiposo, sensibilità all'insulina e funzione beta-cellulare in pazienti obesi diabetici e non diabetici: effetti della chirurgia bariatrica. Rep. Sci. 2017;7:9007.
- 27.
Meng Y, Zhang M, Ling H, Huang S, Miao Q, Yu Y, et al. Embolia grassa multiorgano non traumatica: un caso autoptico e revisione della letteratura. Am J Forensic Med Pathol. 2020;41:131–4.
- 28.
Hirschbuhl K, Dintner S, Beer M, Wylezich C, Schlegel J, Delbridge C, et al. Mappatura virale in COVID-19 deceduto nella serie di autopsie di Augusta della prima ondata: un approccio multiorgano e multimetodologico. PLoS UNO. 2021;16:e0254872.
- 29.
Reiterer M, Rajan M, Gomez-Banoy N, Lau JD, Gomez-Escobar LG, Ma L, et al. L'iperglicemia nel COVID-19 acuto è caratterizzata da insulino-resistenza e infettività del tessuto adiposo da SARS-CoV-2. Metabolismo cellulare 2021;33:2174–88 e5.
- 30.
Goldsmith CS, Tatti KM, Ksiazek TG, Rollin PE, Comer JA, Lee WW, et al. Caratterizzazione ultrastrutturale del coronavirus SARS. Emerg Infect Dis. 2004;10:320–6.
- 31.
Ghadially F. Patologia ultrastrutturale della cellula e della matrice. 1997 (Butterworth-Heinemann, Boston).
- 32.
Giordano A, Murano I, Mondini E, Perugini J, Smorlesi A, Severi I, et al. Gli adipociti obesi mostrano caratteristiche ultrastrutturali delle cellule stressate e muoiono di pirotosi. J Lipid Res. 2013;54:2423–36.
- 33.
Perlman S, Netland J. Coronaviruses post-SARS: aggiornamento su replicazione e patogenesi. Nat Rev microbiolo. 2009;7:439–50.
- 34.
Lagana SM, Kudose S, Iuga AC, Lee MJ, Fazlollahi L, Remotti HE, et al. Patologia epatica in pazienti che muoiono di COVID-19: una serie di 40 casi inclusi dati clinici, istologici e virologici. Mod Pathol. 2020;33:2147–55.
- 35.
Frasca D, Diaz A, Romero M, Garcia D, Jayram D, Thaller S, et al. Identificazione e caratterizzazione di anticorpi umani derivati dal tessuto adiposo con specificità “Anti-self”. Immunolo anteriore. 2020;11:392.
- 36.
Frasca D, Reidy L, Romero M, Diaz A, Cray C, Kahl K, et al. La maggior parte degli anticorpi specifici per SARS-CoV-2 nei pazienti con obesità COVID-19 sono autoimmuni e non neutralizzanti. Int J Obes. 2021;1–6. https://doi.org/10.1038/s41366-021-01016-9 .
- 37.
Puray-Chavez M, LaPak KM, Schrank TP, Elliott JL, Bhatt DP, Agajanian MJ, et al. Analisi sistematica dell'infezione da SARS-CoV-2 di una cellula delle vie aeree umane ACE2-negativa. Cell Rep. 2021;36:109364.
- 38.
Hikmet F, Mear L, Edvinsson A, Micke P, Uhlen M, Lindskog C. Il profilo di espressione proteica di ACE2 nei tessuti umani. Mol Syst Biol. 2020;16:e9610.
- 39.
Cantuti-Castelvetri L, Ojha R, Pedro LD, Djannatian M, Franz J, Kuivanen S, et al. Neuropilin-1 facilita l'ingresso e l'infettività delle cellule SARS-CoV-2. Scienza. 2020;370:856–60.
- 40.
Giordano A, Cesari P, Capparuccia L, Castellucci M, Cinti S. Sema3A e neuropilin-1 espressione e distribuzione nel tessuto adiposo bianco di ratto. J Neurocytol. 2003;32:345–52.
- 41.
Ganesan SK, Venkatratnam P, Mahendra J, Devarajan N. Aumento della mortalità dei pazienti affetti da diabete infetti da COVID-19: ruolo delle proteasi della furina. Int J Obes. 2020;44:2486–8.
- 42.
Ragotte RJ, Pulido D, Donnellan FR, Hill ML, Gorini G, Davies H, et al. La basigina umana (CD147) non interagisce direttamente con la glicoproteina della punta SARS-CoV-2. mSfera. 2021;6:e0064721.
- 43.
Konopka KE, Nguyen T, Jentzen JM, Rayes O, Schmidt CJ, Wilson AM, et al. Danno alveolare diffuso (DAD) risultante dalla malattia di coronavirus 2019 L'infezione è morfologicamente indistinguibile da altre cause di DAD. Istopatologia. 2020;77:570–8.
- 44.
Wellman TJ, de Prost N, Tucci M, Winkler T, Baron RM, Filipczak P, et al. Attivazione metabolica polmonare come biomarcatore precoce della sindrome da distress respiratorio acuto e dell'eterogeneità dell'espressione genica locale. Anestesiologia. 2016;125:992–1004.
- 45.
Alexa AL, Onutu AH. Sindrome da embolia grassa che imita un'infezione da COVID-19. Cura del critico del rappresentante del caso. 2021;2021:5519812.
- 46.
ISS. Istituto Superiore di Sanità-Etica della ricerca durante la pandemia di COVID-19: studi osservazionali e, in particolare, epidemiologici. 2020.
- 47.
Cinti S, Zingaretti MC, Cancello R, Ceresi E, Ferrara P. Tecniche morfologiche per lo studio del tessuto adiposo bruno e del tessuto adiposo bianco. Metodi Mol Biol. 2001;155:21–51.
- 48.
de Wilde AH, Raj VS, Oudshoorn D, Bestebroer TM, van Nieuwkoop S, Limpens R, et al. La replicazione del MERS-coronavirus induce una grave citopatologia in vitro ed è fortemente inibita dal trattamento con ciclosporina A o interferone-alfa. J Gen Virol. 2013;94:1749–60.
- 49.
Alessandrini F, Caucci S, Onofri V, Melchionda F, Tagliabracci A, Bagnarelli P, et al. Valutazione del pannello di ricerca ionico AmpliSeq SARS-CoV-2 mediante sequenziamento parallelo massiccio. Geni. 2020;11:929–941.
- 50.
Rodriguez AM, Elabd C, Amri EZ, Ailhaud G, Dani C. Il tessuto adiposo umano è una fonte di cellule staminali multipotenti. Biochimie. 2005;87:125–8.
- 51.
Cummings BS, Schnellmann RG. Misurazione della morte cellulare nelle cellule di mammifero. Curr Protoc Pharmacol. 2004.
- 52.
Colleluori G, Graciotti L, Pesaresi M, Di Vincenzo A, Perugini J, Di Mercurio E, et al. L'infiammazione del grasso viscerale e l'embolia grassa sono associate alle membrane ialine lipidiche del polmone nei pazienti con COVID-19. bioRxiv. 2021. https://doi.org/10.1101/2021.10.30.466586 .
Ringraziamenti
Questo studio è stato finanziato dal Fondo Integrativo Speciale per la Ricerca del Ministero dell'Università e della Ricerca italiano; numero di borsa: FISR2020IP_05217, e sostenuta da Progetti di Rilevante Interesse Nazionale (PRIN 2017, #2017L8Z2) e da Fondazione Cariplo a EN (sovvenzione 2016-1006). I risultati di questo studio sono stati resi disponibili il 1 novembre 2021 su bioRxiv [ 52 ].
Informazioni sull'autore
Affiliazioni
Contributi
GC, LG, MP, AG e SC: concettualizzazione dello studio. GC, LG e SC: coordinamento dello studio. MP e AT: raccolti campioni autoptici e dati clinici. Studi istologici GC, MP e ADV su campioni autoptici e colture cellulari. CMZ, LG e SC: studi di microscopia elettronica. JP, EDM, AL e CD: studi in vitro su hMADS. SC, PB e SM: infezione da SARS-CoV-2 per gli studi in vitro. GC, LG, MP, JP, EN, SM, AG e SC: analisi e interpretazione dei dati. Tutti gli autori approvano la versione finale del manoscritto e si assumono la responsabilità del suo contenuto.

Nessun commento:
Posta un commento